Sản xuất thuốc không đạt chuẩn, 2 công ty dược bị xử phạt 140 triệu đồng
Theo dõi Pháp luật & Xã hội trên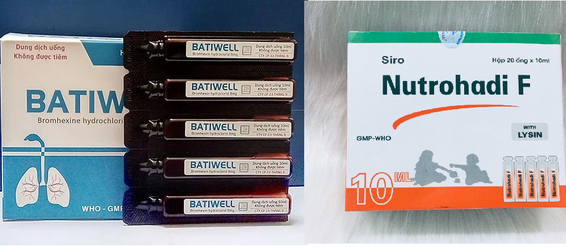 |
| 2 sản phẩm bị buộc thu hồi và xử lý theo quy định (ảnh minh họa) |
Cục Quản lý dược (Bộ Y tế) vừa ban hành 2 quyết định xử phạt hành chính 140 triệu đồng đối với 2 công ty dược, đồng thời buộc thu hồi, tiêu hủy toàn bộ 2 lô thuốc vi phạm chất lượng mức độ 2.
Cụ thể, tại Quyết định số 745/QĐ-XPHC ngày 16/11/2022 của Cục Quản lý Dược, Công ty Cổ phần 23 tháng 9 (địa chỉ trụ sở chính: Quận 6, TP.HCM) bị xử phạt vi phạm hành chính 70 triệu đồng.
Lý do xử phạt là bởi công ty này sản xuất thuốc Batiwell (số giấy đăng ký lưu hành VD-31011-18, số lô 00121, ngày sản xuất 8/3/2021, hạn dùng 8/3/2024) không đạt tiêu chuẩn chất lượng về chỉ tiêu độ đồng đều thể tích và độ đồng đều hàm lượng (vi phạm mức độ 2).
Batiwell là chất có tác dụng long đờm, thuốc dung dịch uống Batiwell được chỉ định để hỗ trợ điều trị nhiễm khuẩn đường hô hấp cấp hoặc mạn tính có ho xuất tiết.
Còn tại Quyết định số 746/QĐ-XPHC ngày 16/11/2022 của Cục Quản lý Dược, Công ty Cổ phần Dược Hà Tĩnh (địa chỉ trụ sở chính: TP. Hà Tĩnh, tỉnh Hà Tĩnh) cũng bị xử phạt vi phạm hành chính 70 triệu đồng.
Nguyên nhân là do công ty này sản xuất thuốc vi phạm chất lượng mức độ 2 đối với với một lô thuốc Nutrohadi F. Thuốc này có số giấy đăng ký lưu hành VD-18684-13, số lô: 030221, ngày sản xuất 24/2/2021, hạn dùng 23/2/2024.
Nutrohadi F là một dạng thuốc bổ sung các nhóm vitamin, khoáng chất và acid amin. Thuốc được sử dụng khi chế độ ăn uống không đủ dinh dưỡng, bệnh nhân đang dưỡng bệnh và trẻ em đang phát triển.
Ngoài việc phải nộp phạt hành chính vào ngân sách Nhà nước trong vòng 10 ngày theo các quyết định nói trên, Công ty Cổ phần 23 tháng 9 và Công ty Cổ phần Dược Hà Tĩnh buộc phải thu hồi và tiêu hủy toàn bộ số thuốc vi phạm chất lượng nói trên.

Pháp luật và Xã hội
Mở Zalo, bấm quét QR để quét và xem trên điện thoại






































