Thuốc điều trị ung thư đại trực tràng bị Bộ Y tế thu hồi giấy đăng ký lưu hành
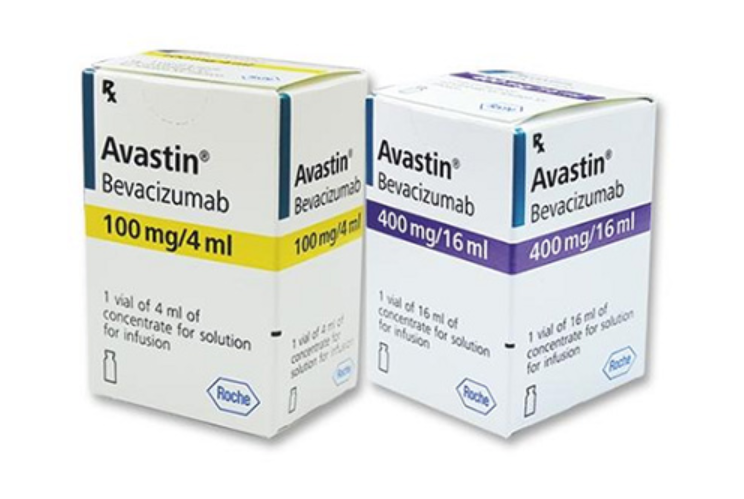 |
| 2 loại thuốc chuyên điều trị ung thư đại trực tràng bị thu hồi giấy đăng ký lưu hành đợt này |
Cục Quản lý Dược (Bộ Y tế) cho biết, đơn vị này mới đây đã có quyết định thu hồi giấy đăng ký lưu hành thuốc tại Việt Nam đối với 4 loại thuốc của nước ngoài.
Đó là các thuốc:
1. Thuốc Avastin (Bevacizumab 100mg/4ml) số đăng ký: SP3-1226-21
2. Thuốc Avastin (Bevacizumab 400mg/16ml) số đăng ký: SP3-1227-21
3. Thuốc Mircera (Methoxy Polyethylene glycol - epoetin beta 100mcg) số đăng ký: QLSP-1151-19
4. Thuốc Albuminar-25 (Human Albumin 12,5g/50ml) số đăng ký: SP-1184-20.
Trong số này, 2 loại thuốc Avastin (Bevacizumab 100mg/4ml) và thuốc Avastin (Bevacizumab 400mg/16ml) do Công ty Genentech Inc. (Mỹ) sản xuất, Công ty F.Hoffmann-La Roche Ltd (Thụy Sĩ) đóng gói và đăng ký lưu hành là thuốc chuyên điều trị bệnh ung thư đại trực tràng.
2 loại thuốc còn lại là thuốc Mircera (Methoxy Polyethylene glycol - epoetin beta 100mcg) do Công ty Roche Diagnostics GmbH (Đức) sản xuất được sử dụng trong điều trị thiếu máu; còn thuốc Albuminar-25 (Human Albumin 12,5g/50ml) do Công ty CSL Behring LLC (Mỹ) sản xuất, Công ty Unico Alliance Co., Ltd. (Hồng Kông) đăng ký lưu hành là dung dịch huyết tương.
Theo Cục Quản lý Dược, việc thu hồi giấy đăng ký lưu hành thuốc tại Việt Nam đối với 4 thuốc trên là do cơ sở sản xuất, hoặc cơ sở đăng ký thuốc, nguyên liệu làm thuốc đề nghị thu hồi giấy đăng ký lưu hành thuốc, nguyên liệu làm thuốc tại Việt Nam (theo quy định tại điểm g, khoản 1 điều 58 Luật Dược số 105/2016/QH13 và khoản 5 điều 40 Thông tư số 08/2022/TT-BYT).
Cục Quản lý Dược lưu ý 4 loại thuốc bị thu hồi giấy đăng ký lưu hành thuốc tại Việt Nam, nếu sản xuất trước ngày quyết định này có hiệu lực và đã nhập khẩu vào Việt Nam, hoặc thuốc nước ngoài nhập khẩu trong trường hợp được giao hàng tại cảng đi của nước xuất khẩu trước ngày quyết định này có hiệu lực thì tiếp tục được phép lưu hành đến hết hạn dùng của thuốc. Cơ sở đăng ký thuốc, sản xuất thuốc phải có trách nhiệm theo dõi, và chịu trách nhiệm về chất lượng, an toàn, hiệu quả của thuốc trong quá trình lưu hành.
Dương Quyên
Đường dẫn bài viết: https://phapluatxahoi.kinhtedothi.vn/thuoc-dieu-tri-ung-thu-dai-truc-trang-bi-bo-y-te-thu-hoi-giay-dang-ky-luu-hanh-316686.html
In bài viếtBản quyền thuộc về "Pháp Luật và Xã hội - Chuyên trang của Báo Kinh tế & Đô thị", chỉ được dẫn nguồn khi có thỏa thuận bằng văn bản.
